 AQUÍ OS DEJO LOS ENLACES SOBRE LAS TAREAS DE REFUERZO DE LA UNIDAD 1 DE FÍSICA Y QUÍMICA PARA 3ºESO.
AQUÍ OS DEJO LOS ENLACES SOBRE LAS TAREAS DE REFUERZO DE LA UNIDAD 1 DE FÍSICA Y QUÍMICA PARA 3ºESO.
ENLACE 2
(SOLO HASTA LA UNIDAD 1)
(SOLO HASTA LA UNIDAD 1)
Este blog pretende ser un rincón divulgativo sobre aspectos relacionados con la Ciencia. Sobre todo pretende ser una herramienta más, en el aprendizaje educativo del ámbito científico. En especial se hará énfasis en la materias de Física y Química a nivel de ESO y Bachillerato.
 AQUÍ OS DEJO LOS ENLACES SOBRE LAS TAREAS DE REFUERZO DE LA UNIDAD 1 DE FÍSICA Y QUÍMICA PARA 3ºESO.
AQUÍ OS DEJO LOS ENLACES SOBRE LAS TAREAS DE REFUERZO DE LA UNIDAD 1 DE FÍSICA Y QUÍMICA PARA 3ºESO.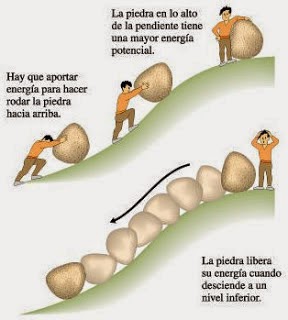

 EL ÁTOMO
EL ÁTOMO 2) diluciones seriadas de un neurotransmisor.
2) diluciones seriadas de un neurotransmisor.